Page 96 - 113中文衛福年報
P. 96
中華民國 113年版 衛生福利年報
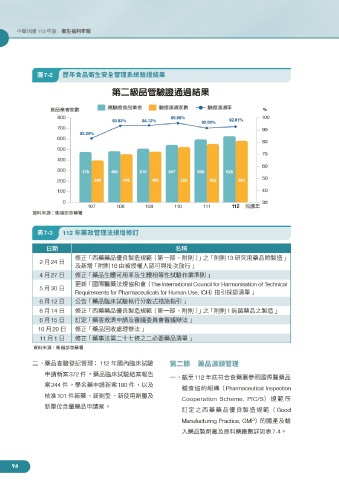
圖7-2 歷年食品衛生安全管理系統驗證結果
第二級品管驗證通過結果
食品業者家數 應驗證食品業者 驗證通過家數 驗證通過率 %
800 95.98% 100
93.83% 94.12% 92.00% 92.81%
700 90
83.26%
600
80
500
70
400
60
300 478 486 510 547 600 626
200 398 456 480 525 552 581 50
100 40
0 30
107 108 109 110 111 112 民國年
資料來源:衛福部食藥署
表7-3 112年藥政管理法規增修訂
日期 名稱
修正「 西藥藥品優良製造規範( 第一部 、附則 )」之「 附則13研究用藥品的製造 」
2月24日
及新增「 附則16由被授權人認可與批次放行 」
4月27日 修正「 藥品生體可用率及生體相等性試驗作業準則 」
更新「 國際醫藥法規協和會(The International Council for Harmonisation of Technical
5月30日
Requirements for Pharmaceuticals for Human Use, ICH )指引採認清單 」
6月12日 公告「 藥品臨床試驗執行分散式措施指引 」
6月14日 修正「 西藥藥品優良製造規範( 第一部 、附則 )」之「 附則1無菌藥品之製造 」
6月15日 訂定「 藥害救濟申請及審議委員會審議辦法 」
10月20日 修正「 藥品回收處理辦法 」
11月1日 修正「 藥事法第二十七條之二必要藥品清單 」
資料來源:衛福部食藥署
二、 藥品查驗登記管理: 112年國內臨床試驗 第二節 藥品源頭管理
申請新案372件 ,藥品臨床試驗結案報告 一、 截至112年底符合食藥署參照國際醫藥品
案244件 ,學名藥申請新案180件 ,以及 稽查協約組織( Pharmaceutical Inspection
核准101件新藥 、新劑型 、新使用劑量及 Cooperation Scheme, PIC/S )規 範 所
新單位含量藥品申請案 。 訂定之西藥藥品優良製造規範( Good
Manufacturing Practice, GMP )的國產及輸
入藥品製劑廠及原料藥廠數詳如表7-4。
94